- 手机:18438616290
电话:021-38015121
联系人:Absin
邮箱:lanwu@univ-bio.com
网址:http://www.absin.cn/
地 址:上海市浦东新区新浩路58号18号楼

Absin《GUT》IF23.059高分文献解析(下)
2021-12-10
|
——胰腺癌转移新机制与靶向治疗新策略的提出
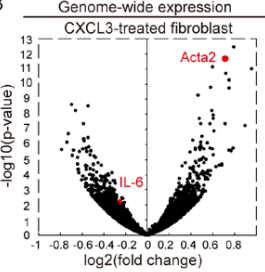
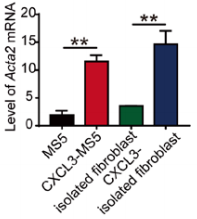
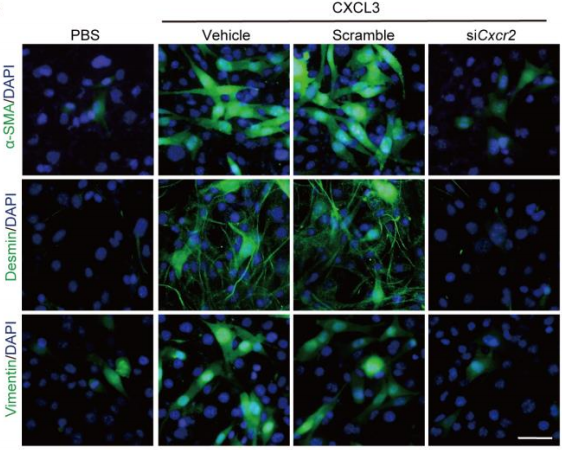
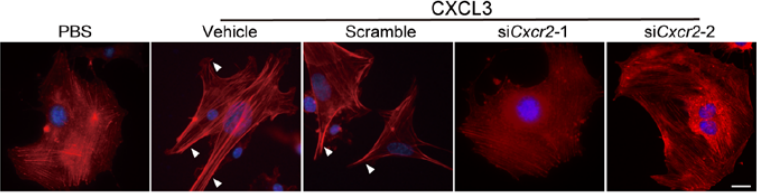
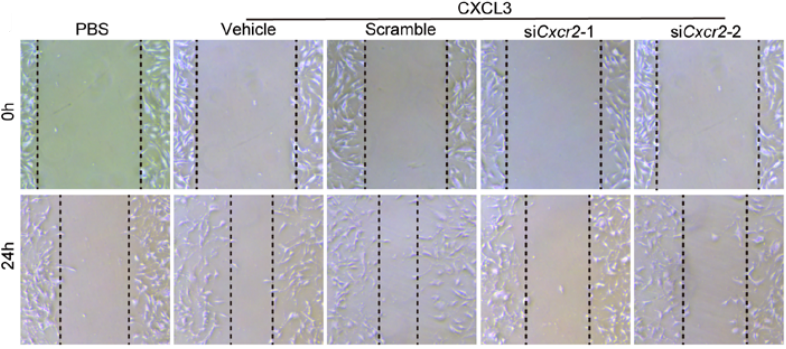
一、CXCL3-CXCR2的激活促进了纤维母细胞向肌成纤维细胞的转变 研究团队分离了原代小鼠的成纤维细胞,然后用CXCL3去进行刺激,随后进行RNA-seq分析,结果显示其中与细胞侵袭和迁移相关的基因高度上调,包括wnt1诱导的信号通路蛋白2(WSP2)和阿尔法平滑肌肌动蛋白(α-SMA,Acta2);火山图则显示了在CXCL3刺激处理的成纤维母细胞中,Acta2异常高表达,而IL-6表达则相对低(图1)。对人和小鼠成纤维母细胞中的Acta2进行定量检测,发现CXCL3刺激的成纤维母细胞表达Acta2的量明显增多(图2)。除此之外,另一种肌纤维化标志物结合蛋白(Desmin)和波形蛋白(Vimentin)表达也明显升高,且表现为剂量依赖性。通过免疫荧光染色进一步证实,肌纤维化转变是CXCR2依赖性的(图3)。
这些结果表明, CXCL3激活CXCR2会导致纤维母细胞向肌成纤维细胞转变(FMT),并且也会促进成纤维细胞的迁移。
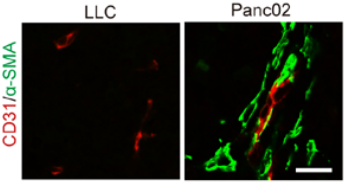
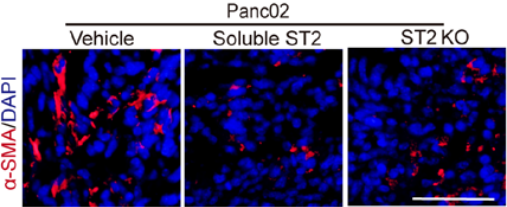
二、FMT中ST2和CXCR2信号通路之间的关联性 对迁移和转移相关基因的分析表明,α-SMA(Acta2)的表达量最高;同样,在CXCL3刺激的成纤维细胞中,GTP-结合蛋白Rac也升高(图6)。将小鼠的PDAC组织与肺癌组织相比,PDAC组织α-SMA阳性信号显著高于肺癌组织(图7),当ST2基因缺失或被药物抑制以后,α-SMA在PDAC肿瘤组织中的表达就几乎完全被阻断了(图8)。
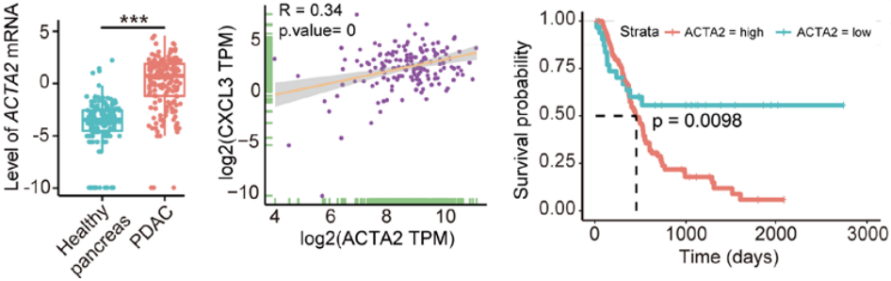
在PDAC胰脏中α-SMA(Acta2)的表达显著高于健康组,而该指标又与CXCL3的表达息息相关,最重要的是α-SMA也关系到患者的生存率,该指标表达高的患者预后更差(图9)。
综上所述,α-SMA作为CAFs的标志物,和PDAC的转移密切相关,而ST2和CXCL3都会影响α-SMA的表达,因此这两个指标在FMT过程中起着重要作用。
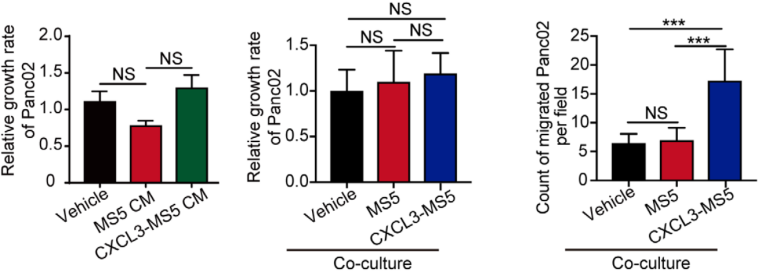
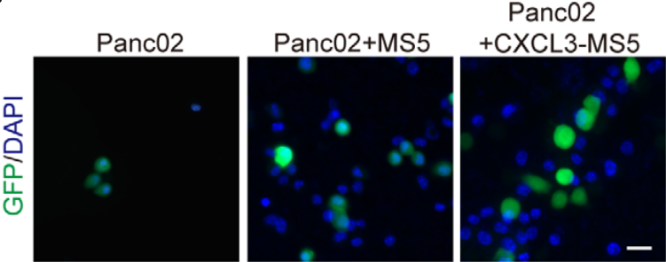
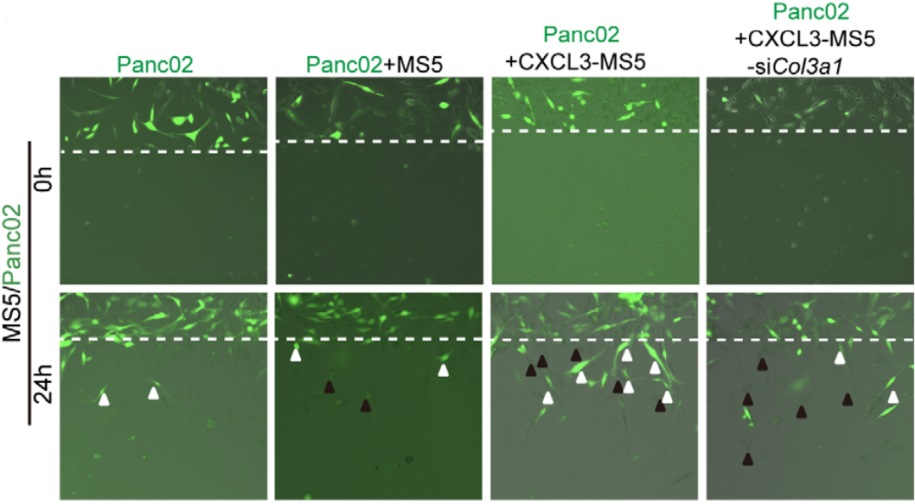
三、CXCL3刺激肌成纤维细胞会促进癌症转移 研究结果显示,CXCL3刺激肌成纤维细胞不会促进Panc02胰腺癌细胞的增殖,但是却显著刺激了它的运动性(图10)。为了解释CXCL3诱导的肌成纤维细胞和PDAC细胞之间相互作用的机制,研究团队开发了一个体外共培养系统来研究细胞运动,分别将Panc02细胞和空白载体、肌成纤维细胞以及CXCL3刺激的肌成纤维细胞进行共培养,一段时间后进行荧光染色检测:肌成纤维细胞和PDAC在体外形成簇,CXCL3的刺激进一步促进了簇的形成(图11)。
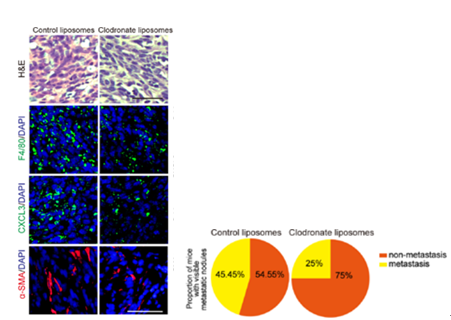
四、PDAC的转移依赖于ST2-TAM-CXCR2通路 为了将所得的发现和临床相结合,研究团队开发了PDAC转移模型。首先为了验证了TAMs是 CXCL3的主要细胞来源,研究团队设置了一组巨噬细胞清除小鼠,用氯膦酸二钠脂质体对Panc02肿瘤小鼠进行处理,结果正如预期,在TAMs缺失后,肿瘤组织中CXCL3和α-SMA 的表达水平显著降低。与此同时,统计发现经氯膦酸二钠脂质体处理后,有明显转移结节的小鼠数量出现减少,这一现象和CXCL2、α-SMA的表达水平降低相一致(图14)。类似的,当ST2基因缺失或它的功能被药理抑制以后,肿瘤中成熟TAMs的量显著降低,进而CXCL3的表达和转移性病变的比例也降低(图15)。
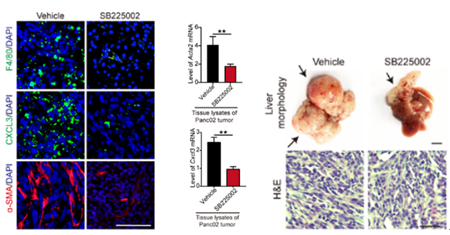
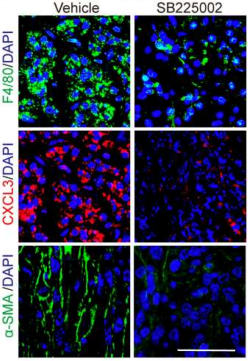
查阅资料得知,在人体内,PDAC通常通过门静脉转移到肝脏,于是研究团队建立了一个能够通过门静脉途径发生自发性转移的临床相关转移模型,对该模型使用SB225002(CXCR2拮抗剂),发现成熟TAMs、CXCL3以及α-SMA的量都减少了,证明了SB225002治疗能显著抑制PDAC的肝转移(图16)。对另外两种荷瘤小鼠(K518和K399)进行同样的试验,发现SB225002对PDAC的肺转移抑制作用也很显著,进一步证实了CXCR2被拮抗后,PDAC的转移会被抑制。此外,研究团队还建立了PDAC原位肿瘤模型(K399),直接将肿瘤植入小鼠胰腺,结果发现用SB225002治疗后也得到了相同的结果,三种指标量都减少(图17)。
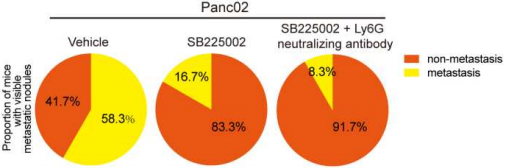
为了排查模型中中性粒细胞/髓系来源的抑制细胞是否参与促进转移,研究团队用了Ly6G中和抗体联合SB225002共同治疗PDAC患者,但联合应用对比单独用SB225002,只轻微加强了抑制转移的作用,因此得出结论,中性粒细胞/髓系来源的抑制细胞在介导IL-33- CXCL3-CXCR2诱导的转移中只发挥次要作用(图18)。
综上结果表明ST2-TAMs-CXCL3-CXCR2轴是促进PDAC转移的关键信号通路。
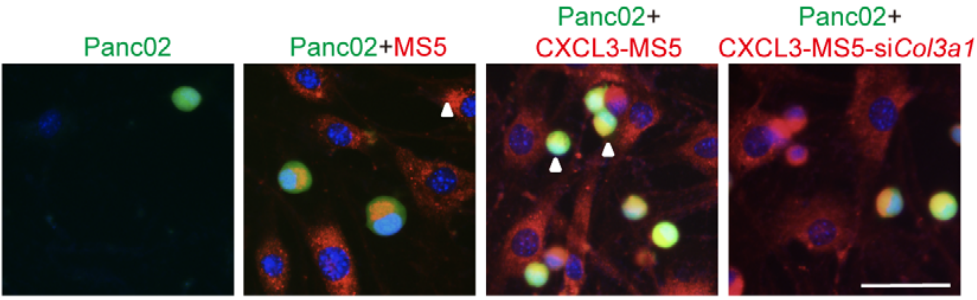
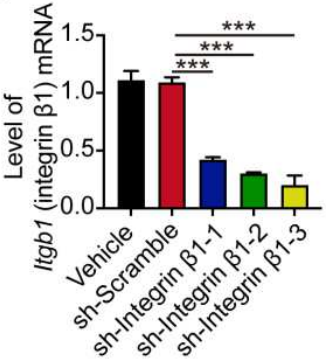
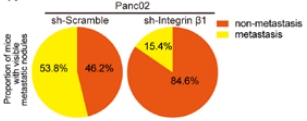
五、整合素β-1的破坏可抑制PDAC的转移 已知整合素α1β1和α2β1介导与III型胶原蛋白的相互作用,研究团队为了探讨β1整合素的破坏对Panc02型PDAC转移的潜在影响,采用shRNA特异性靶向敲除β1整合素基因的三个独立编码区来下调β1整合素(图19),而β1整合素的下调又显著抑制了PDAC的转移(图20)。 这些发现表明,β1整合素对于介导III型胶原蛋白-整合素的相互作用和PDAC转移至关重要。
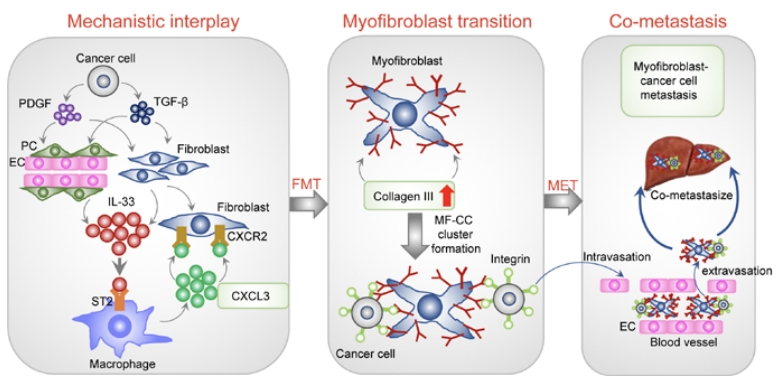
结语: 李琦教授团队用了免疫学、基因学、统计学等种种方法,采用了多种样本和模型,对可能影响PDAC增殖、转移的关键靶点和因素进行层层研究,最后汇集成一个完整的机制图(图21):癌症细胞和其他基质细胞如血管内皮细胞产生血小板衍生的生长因子(PDGFs)和转化生长因子β(TGFβ),激活肿瘤微环境中的成纤维细胞和血管周围细胞。被激活的CAFs和血管周围细胞产生高水平的IL-33主要靶向ST2+炎性巨噬细胞。IL-33刺激的肿瘤相关巨噬细胞(TAMs)通过MYC驱动表达高水平的CXCL3。CXCL3通过其在CAFs上表达的特定受体(CXCR2)诱导成纤维细胞向肌成纤维细胞转化(FMT)。CXCL3诱导的myoCAFs在其表面表达高水平的胶原蛋白III(Col3a1),并通过整合素结合劫持胰腺癌细胞。MyoCAFs作为一种驱动力,以转移性myoCAF-PDAC集群的形式携带PDAC癌细胞转移,它可能帮助癌细胞内渗,外渗,形成最初的转移位,并在远端器官(如肝脏)上重新生长。 尽管PDAC如今还无法治愈,但是李琦教授团队的研究结果提出了几个可能抑制癌细胞进一步转移的靶点,这对于治疗这一癌症提供了新的思路;而且这些信号通路也可能适用于其他实体瘤,也为其他肿瘤的研究提供了新的研究方向。
等亿等!还没完! 火眼金睛的您肯定注意到文中有一些免疫组化的“美图”,这里就不得不提到我们的免疫组化二抗试剂盒(abs957)了!拆盒即用,成倍放大信号,有效节省一抗;更清晰的显色,更干净的背景,绝对是您组化的得力助手!
|