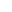- 手机:18438616290
电话:021-38015121
联系人:Absin
邮箱:lanwu@univ-bio.com
网址:http://www.absin.cn/
地 址:上海市浦东新区新浩路58号18号楼

国自然热点│自噬相关信号通路关键蛋白及研究策略
2023-11-16
自噬的研究背景
关于自噬的研究曾获得过两次诺贝尔生理学或医学奖。首次是比利时科学家克里斯汀·德·迪夫(Christian de Duve)因发现了在细胞自噬机制中起到重要作用的溶酶体,获得1974年诺贝尔奖;其次是日本大隅良典团队因探明了细胞自噬的启动机制,获得2016年诺贝尔奖。2023年,国家自然科学基金委员会揭晓的今年国自然评审结果,自噬相关研究的中标数量超500项(来源:ZCOOL国自然项目查询系统)!
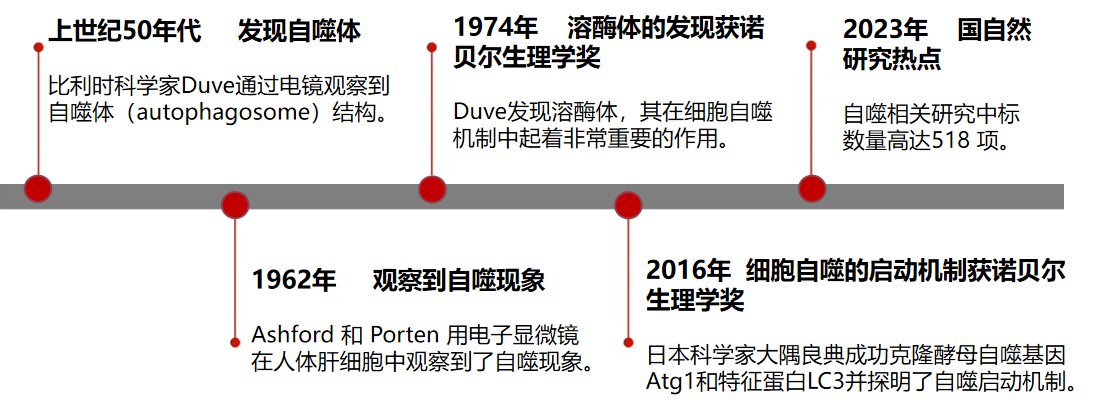
图1 自噬研究进程
什么是自噬?
自噬是细胞在相关基因(autophagy related gene,Atg)的调控下利用溶酶体降解自身的细胞器和大分子物质的过程,以此实现细胞本身的代谢需要和某些细胞器的更新,是真核细胞特有的生命现象。简单来说就是细胞自己吃自己、废物再利用。自噬现象在机体的生理和病理过程中都会发生,常见的病理诱导因素包括:营养缺乏、能量代谢异常、缺血、缺氧、病原体感染等。
细胞自噬主要有三种形式:微自噬(microautophagy)、巨自噬(macroautophagy,通常也称作自噬)和分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA),它们的主要不同之处在于产物(货物)进入溶酶体的分子途径(图2)。
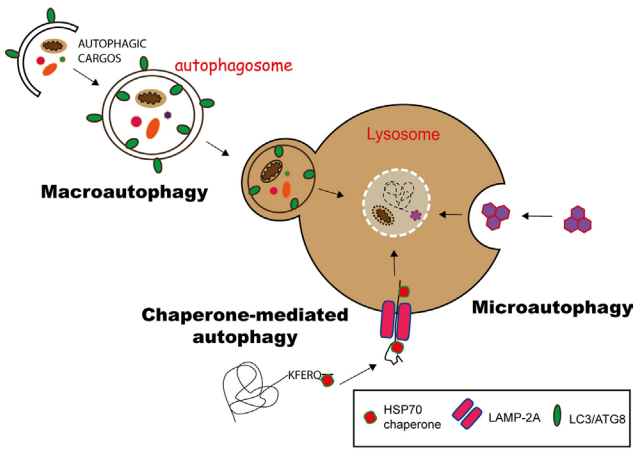
图2 三种自噬途径[1]
在分子伴侣介导的自噬(CMA)中,具有KFERQ样基序的蛋白质在Hsp70伴侣的帮助下通过LAMP-2A转运蛋白转运到溶酶体中。微自噬(microautophagy)涉及通过内陷溶酶体膜来隔离底物,而在巨自噬(macroautophagy)中,底物被吞噬在称为自噬小体的双层膜小泡中,自噬小体随后与溶酶小体融合,提供其内容物以供降解。
自噬相关信号通路及关键蛋白
自噬过程受到不同自噬相关基因(autophagy-related gene,ATG)的调控, 据报道目前大约已有40个在酵母和哺乳动物中高度保守的自噬相关基因被发现。自噬发生需要经过以下几个阶段:自噬前体形成、自噬前体延长包裹自噬的底物形成自噬泡(Phagophore)、细长自噬泡关闭形成自噬体(Autophagosome)、自噬体与溶酶体融合形成自噬溶酶体(Autolysosome)完成底物降解。
图3 自噬过程[2]
典型的自噬(巨自噬)如图3所示,在营养缺乏等应激情况下,AMPK的激活或mTOR的抑制导致ULK的激活,ULK使Beclin-1磷酸化,导致VPS34的激活和吞噬细胞的形成。ULK在与FIP200和ATG13的复合体中发挥作用,而VPS34的功能需要一个调节亚基VPS15(P150)和Beclin-1,后者进一步调节其他调节因子如AMBRA、ATG14、UVRAG和BIF-1的联系。多种ATG蛋白,如ATG5和ATG7,构成了两个“泛素样结合系统”,它们催化形成磷脂酰乙醇胺(PE)连接的LC3(LC3-II),并将其正确地结合到吞噬体膜上。细长自噬泡的关闭标志着成熟自噬体的形成,自噬体最终与溶酶体融合,导致货物降解、营养物质和代谢物的循环。
表1自噬不同阶段关键蛋白及作用
|
阶段 |
蛋白名称 |
功能 |
|
|
起始及吞噬泡成核 |
ULK1 复合体 |
ATG1/ULK1 |
通过自噬机制的磷酸化组分启动自噬; |
|
ATG13 |
介导ULK1和FIP200之间相互作用的接头; |
||
|
ATG17/FIP200 |
ULK1复合物的组成部分; |
||
|
PI3KC3 复合体 |
ATG6/Beclin1 |
促进PI3KC3-C1复合体形成; |
|
|
VPS34 |
促进PI3KC3-C1复合体的形成,ULK1的磷酸化位点,稳定ULK1复合物。 |
||
|
ATG14 |
ULK1的磷酸化位点; |
||
|
VPS15 |
丝氨酸/苏氨酸激酶; |
||
|
AMBRA |
Beclin1的相互作用蛋白 |
||
|
吞噬泡延伸 |
ATG8/LC3-PE |
ATG8/LC3 |
以LC3-I和LC3-Ⅱ两种形式存在;参与自噬体膜的形成,与自噬体膜表面的PE结合,可作为自噬体的标记分子 |
|
ATG7 |
E1样酶; |
||
|
ATG12-ATG5-ATG16复合体 |
ATG12&ATG5&ATG16 |
ATG5直接结合膜,这种膜结合受ATG12的负调节,但被ATG16激活。 |
|
|
货物包裹 |
关键因子 |
Ubiquitin |
标记货物 |
|
SQSTM1/p62 |
同OPTN、NBR1和NDP52,都是自噬受体,识别货物。 |
||
|
PE-LC3 |
与自噬受体的相互作用; |
||
|
Rabs |
Rab1&Rab11 |
参与自噬体的生物合成 |
|
|
Rab7 |
促进启动阶段自噬体与溶酶体的融合; |
||
|
自噬体与溶酶体融合 |
HOPS 复合体 |
VPS11 |
与VPS16、VPS18、VPS33、VPS39和VPS41共同识别SNAREs复合体并调节其组装, |
|
SNAREs 复合体 |
STX17 |
介导自噬体与溶酶体融合,也参与早期自噬体的成熟。 |
|
|
SNAP29 |
介导自噬体与溶酶体融合。 |
||
|
YKT6 |
与STX17-SNAP29形成复合体,介导自噬体与溶酶体的融合。 |
||
|
VAMP7/8 |
位于溶酶体,介导自噬体与溶酶体的融合。 |
||
细胞自噬研究策略
1、电镜观察自噬体的形成——自噬检测金标准r
自噬体属于亚细胞结构,需要使用透射电子显微镜观察自噬体的形态。电镜检测自噬主要是基于辨认自噬体结构特征(表2)。
表2 自噬不同阶段形态特征
|
自噬阶段 |
特征 |
|
自噬泡(Phagophore) |
新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。 |
|
自噬体(Autophagosome) |
双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。 |
|
自噬溶酶体(Autolysosome) |
单层膜,胞浆成分已降解。 |
依照上述描述,能够确认大部分自噬性囊泡,但有以下问题需要注意:
1)是否存在双层或多层膜不能作为识别自噬体的依据(普通透射电镜切片在制备过程中的处理可影响膜脂质成分,切片上的自噬体并非都是两层膜结构,可能仅有一层膜,也可能是多层膜,有时膜结构可能因为脂质被提取而无法辨认);
2)线粒体也含双层膜,肿胀或含有沉淀物的线粒体外观与自噬体形态相似,但仔细观察,线粒体双层膜间距一般较小且均一,线粒体内膜折叠形成嵴,而自噬体内膜不会折叠;
3)粗面内质网有时会包绕线粒体等细胞器,容易误认为自噬体,根据内质网上有核糖体而自噬体膜上无核糖体可鉴别;
4)切片上的电子密度低或空泡有时也会被误认为自噬囊泡。
2、Western blot检测自噬相关蛋白
在进行自噬研究时,提取蛋白进行Western Blot,检测LC3-I和LC3-II几乎是必做的实验。细胞内存在两种形式的LC3蛋白:LC3-Ⅰ和LC3-Ⅱ。LC3蛋白在合成后其C端即被Atg4蛋白酶切割变成LC3-Ⅰ,分布于细胞浆内。当自噬体形成后,LC3-Ⅰ和磷脂酰乙醇胺(phosphatidylethanolamine, PE)偶联形成LC3-Ⅱ并定位于自噬体内膜和外膜,并稳定地保留在自噬体膜上直到与溶酶体融合。因此,LC3-Ⅱ被用来作为自噬体的标记,其表达水平在某种程度上反映了自噬体的数量[3]。LC3-I/II的形成和降解是一个动态过程,瞬时LC3-Ⅱ表达不能反映自噬程度,需配合使用工具化合物分析自噬变化。
除了检测自噬标志物LC3的转换(LC3-II/LC3-I)外,还可以用Western Blot实验检测Beclin1、P62等自噬相关蛋白的表达情况。Western blot操作包括:总蛋白提取→蛋白含量测定→SDS-PAGE电泳→电转→封闭→抗体孵育→化学发光成像。就操作难度而言,Western blot在一众实验中名列前茅,WB实验具体步骤可参考我们往期分享。
3、自噬的实验性调控——工具化合物
通过人为的干预来激活或者抑制自噬功能后观察细胞行为或效应分子的变化能够使研究结论更具有说服力。目前,常用的抑制自噬及诱导自噬的药物及机制如表3所示。需要注意的是,这些工具药普遍存在的缺陷就是特异性不强,在抑制自噬的同时对细胞其他代谢过程也可能会有影响。如3-MA抑制ClassⅢ PI3K的同时对ClassⅠ PI3K同样也有抑制作用,继而抑制Akt/mTOR通路,激活自噬。
表3 细胞自噬常用的激活剂和抑制剂
|
类别 |
工具化合物 |
作用原理 |
|
自噬 激活剂 |
Metformin hydrochloride |
AMPK激活剂 |
|
Rapamycin、Torin-1、Torkinib、AZD-8055 |
mTOR 抑制剂 |
|
|
ABT-737 |
竞争性破坏Beclin-1/ Bcl-2/Bcl-XL间的相互作用 |
|
|
自噬 抑制剂 |
3-MA、LY 294002、Wortmannin、Spautin-1 |
PI3K抑制剂,抑制自噬泡的形成 |
|
Nocodazole、Bafilomycin A1 |
抑制自噬体与溶酶体的融合 |
|
|
Aloxistatin、Pepstatin A |
抑制溶酶体蛋白酶活性 |
4、应用 GFP-LC3 转基因小鼠实现体内自噬的实时监测
Tian等[4]利用GFP-LC3转基因小鼠,借助于体内成像技术经颅骨检测实验性脑卒中后缺血脑组织区域GFP荧光强度,与体外自噬成像、自噬抑制剂3-甲基腺嘌呤(3-MA)检测、蛋白印迹分析、免疫组织化学、免疫荧光等分析方法结果相似。该研究提供了活体自噬检测的证据,展示了一种在活体动物模型中检测体内自噬的方法,此方法对监测活体中风患者体内的自噬过程以及阐明自噬在脑缺血和其他神经疾病中的详细作用具有重要价值。
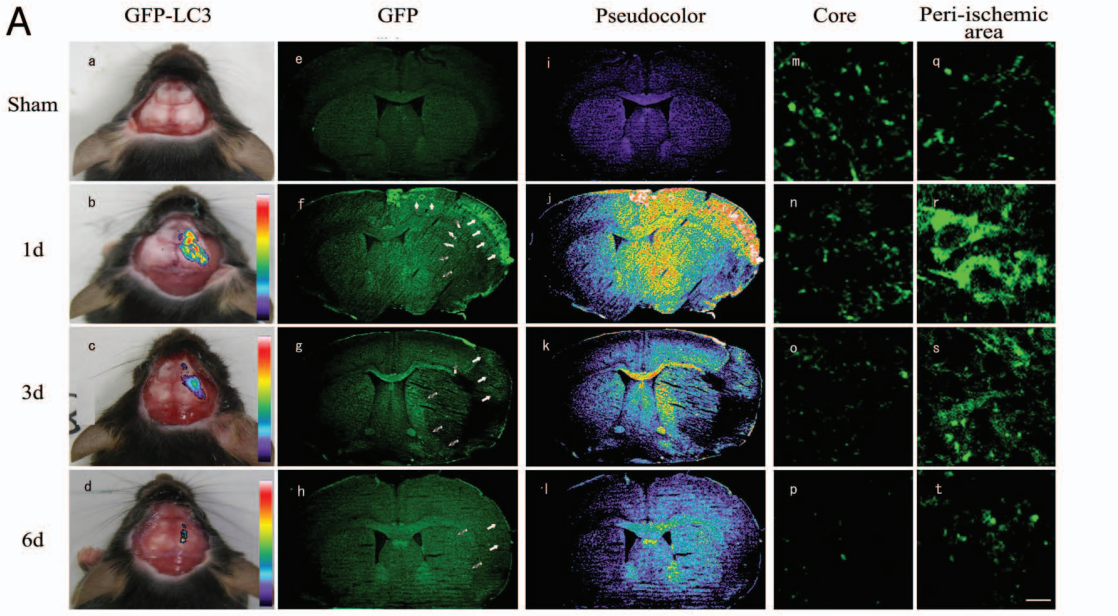
图4 脑缺血区头部活体成像监测GFP荧光信号
自噬研究已成为当前生命科学研究的热点,揭示自噬的发生机制、自噬与疾病发生的关系对预防与治疗多种人类重大疾病具有重要意义。然而,至今并没有非常准确可靠的自噬功能检测和监控方法,我们在进行自噬相关研究时应结合不同的检测原理,借助不同的检测技术进行分析,体内外结果互相验证以避免单一技术的局限性。
参考文献:
[1] Duraes F V , Jennifer N , Juan D ,et al.Macroautophagy in Endogenous Processing of Self- andPathogen-Derived Antigens for MHC Class II Presentation[J].Frontiers in Immunology, 2015, 6. DOI:10.3389/fimmu.2015.00459.[2] Michelle Cicchini; Vassiliki Karantza; Bing Xia.Molecular Pathways: Autophagy in Cancer-A Matter of Timing and Context[J].Clinical Cancer Research.2015,21 (3): 498-
[3] Kimura S, Fujita N, Noda T, et al. Monitoring autophagy inmammalian cultured cells through the dynamics of LC3. Methods Enzymol, 2009, 452: 1-12.
[4] Tian F, Deguchi K, Yamashita T, et al. In vivo imaging of autophagy in a mouse stroke model. Autophagy, 2010, 6(8): 1107-1114.
自噬激活剂:
|
货号 |
产品名称 |
CAS号 |
规格 |
|
abs810030 |
Rapamycin |
53123-88-9 |
100 mg |
|
abs810772 |
AZD-8055 |
1009298-09-2 |
50 mg |
|
abs812114 |
ABT-737 |
852808-04-9 |
50 mg |
|
abs812923 |
Torin-1 |
1222998-36-8 |
20 mg |
|
abs817883 |
Metformin hydrochloride |
1115-70-4 |
100 mg |
|
abs810030 |
Rapamycin |
53123-88-9 |
100 mg |
自噬抑制剂:
|
货号 |
产品名称 |
CAS号 |
规格 |
|
abs810001 |
LY 294002 |
154447-36-6 |
100 mg |
|
abs810575 |
3-MA |
5142-23-4 |
200 mg |
|
abs817875 |
Wortmannin |
19545-26-7 |
10 mg |
|
abs817886 |
Nocodazole |
31430-18-9 |
100 mg |
|
abs817902 |
Pepstatin A |
26305-03-3 |
50 mg |
|
abs817918 |
Aloxistatin |
88321-09-9 |
25 mg |
自噬相关抗体:
|
货号 |
产品名称 |
规格 |
|
abs103336 |
Rabbit anti-Cleaved LC3A Polyclonal Antibody |
50uL |
|
abs113447 |
Rabbit anti-Cleaved LC3B Polyclonal Antibody |
50uL |
|
abs124528 |
Rabbit anti-Nucleoporin p62 Polyclonal Antibody |
50uL |
|
abs131205 |
Rabbit anti-Beclin 1 Polyclonal Antibody |
50? |
|
abs158317 |
Mouse anti-LC3A/B Monoclonal Antibody(3E9) |
100uL |
|
abs158462 |
Mouse anti-LC3A Monoclonal Antibody(8F5) |
100uL |
温馨提示:absin所有产品仅用于科学研究,请勿药物、家用或其他用途。
Absin特色产品线:
|
爱必信(上海)生物科技有限公司 联系邮箱:info@absin.cn 微信公众号:爱必信生物 |
.jpg)
|