- 手机:18438616290
电话:021-38015121
联系人:Absin
邮箱:lanwu@univ-bio.com
网址:http://www.absin.cn/
地 址:上海市浦东新区新浩路58号18号楼

铁死亡信号通路:核心机制与研究策略全景解析
2025-11-25
细胞死亡的神秘世界迎来新成员,铁死亡以其独特的铁依赖性和脂质过氧化特征,在癌症治疗与疾病干预领域开辟了新战场。
铁死亡(Ferroptosis)是一种铁依赖性、脂质过氧化驱动的程序性细胞死亡形式,自2012年正式命名以来,已成为肿瘤抑制、神经退行性疾病及代谢性疾病研究的热点。与凋亡、坏死不同,铁死亡在细胞形态学、生物化学和遗传学上具有独特特征,主要表现为线粒体收缩、膜密度增加和脂质过氧化物积累。本文将系统解析铁死亡的核心信号通路、关键调控因子、先进研究策略及靶向治疗前景,为相关研究提供全面指导。
一、铁死亡的核心生化基础
铁死亡的发生依赖于三个关键生化过程:铁代谢失衡、脂质过氧化和抗氧化防御系统失效。这三个过程相互交织,共同构成了铁死亡的核心生化基础。
铁作为芬顿反应(Fenton reaction)的催化剂,能将过氧化氢转化为高活性的羟基自由基,进而引发脂质过氧化。正常情况下,细胞内铁稳态通过转铁蛋白受体(TfR)、铁泵蛋白(FPN)等精密调控。当细胞内二价铁(Fe2?)过量积累时,会通过芬顿反应产生大量活性氧(ROS),攻击细胞膜上的多不饱和脂肪酸(PUFAs)。PUFAs在酰基辅酶A合成酶长链家族成员4(ACSL4)和溶血磷脂酰胆碱酰基转移酶(LPCAT3)的作用下合成多不饱和脂肪酸磷脂(PUFA-PLs),随后被脂氧合酶氧化生成磷脂过氧化物(PUFA-PL-OOHs),最终导致细胞膜破裂和细胞死亡。
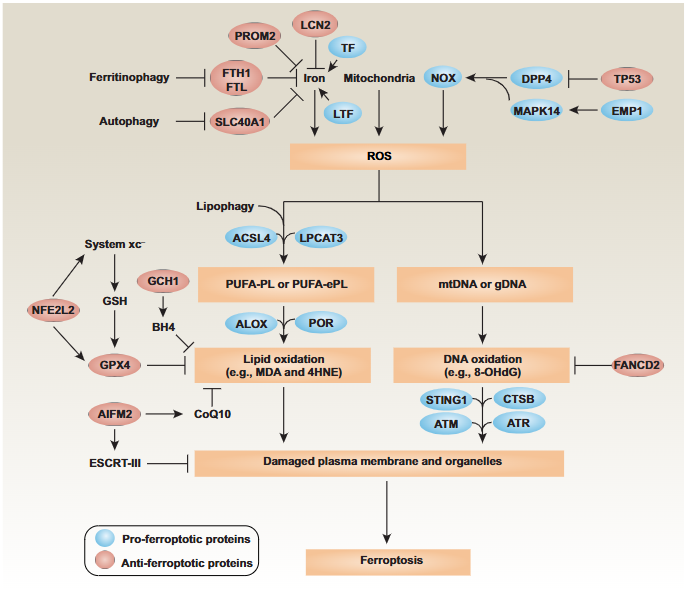
图1 铁死亡信号通路[1]
二、关键信号通路网络
1、GPX4核心调控通路
谷胱甘肽过氧化物酶4(GPX4)是铁死亡最核心的负调控因子。GPX4依赖谷胱甘肽(GSH)将脂质过氧化物还原为无害的脂质醇,从而抑制脂质过氧化积累。胱氨酸/谷氨酸逆向转运体系统Xc-(由SLC7A11和SLC3A2亚基组成)负责将胞外胱氨酸转运入胞,同时将谷氨酸转运出胞。胞内胱氨酸随后还原为半胱氨酸,用于GSH合成。当系统Xc-活性被抑制(如使用Erastin),或GPX4活性被直接抑制(如使用RSL3),都会导致GPX4功能丧失,引发铁死亡。
2、非GPX4依赖的备份系统
近年来研究发现,铁死亡还存在GPX4非依赖的调控机制:
铁死亡抑制蛋白1(FSP1) 通过催化泛醌(CoQ)转化为泛醇(CoQH2),后者直接中和脂质自由基,在质膜上形成独立的抗氧化系统。
GTP环化水解酶1(GCH1) 产生四氢生物蝶呤(BH4),作为一种有效的抗氧化剂,抑制脂质过氧化。
二氢乳清酸脱氢酶(DHODH) 在线粒体中通过类似FSP1的机制抑制铁死亡。
下表总结了铁死亡的主要调控因子及其功能:
表:铁死亡关键调控因子及其功能
|
调控因子 |
功能 |
调控方向 |
|
GPX4 |
还原脂质过氧化物 |
负向调控 |
|
系统Xc- (SLC7A11) |
胱氨酸摄取,GSH合成 |
负向调控 |
|
FSP1 |
泛醇再生,中和脂质自由基 |
负向调控 |
|
GCH1 |
产生BH4,抗氧化 |
负向调控 |
|
ACSL4 |
PUFA-PLs合成 |
正向调控 |
|
NOXs |
ROS产生 |
正向调控 |
|
NANS |
抑制NF-κB-FTH1通路 |
正向调控 |
3、新兴调控节点:NANS与NOXs
最新研究发现,N-乙酰神经氨酸合成酶(NANS)通过调控铁稳态在结直肠癌铁死亡中发挥重要作用。NANS通过直接结合TAK1的N端结构域,阻断TAK1-TAB1复合物形成,抑制TAK1的K63泛素化和磷酸化,进而抑制下游NF-κB信号通路。NF-κB信号通路的下调减少了其对铁蛋白重链1(FTH1)的转录激活,FTH1作为铁储存蛋白,其表达降低导致细胞内游离铁增加,促进铁死亡发生。NADPH氧化酶(NOXs)家族成员(NOX1、NOX2和NOX4)也被证实通过不同机制促进铁死亡。NOX1在p53蛋白调控下与二肽基肽酶4(DPP4)结合介导质膜脂质过氧化;NOX4受EGFR-MAPK信号通路诱导表达,产生H?O?参与芬顿反应。
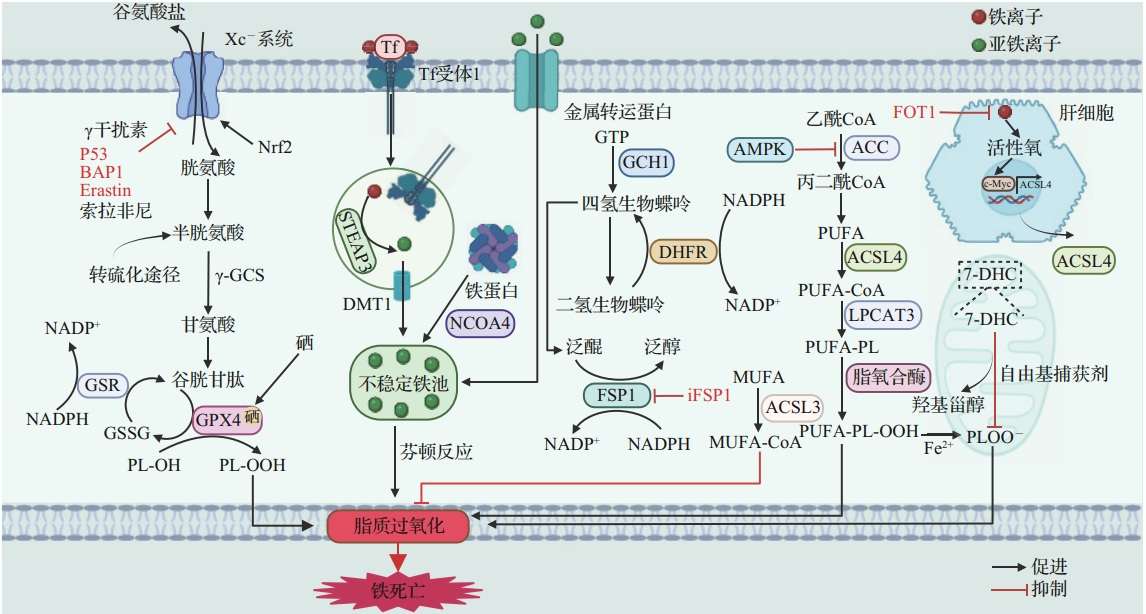
图2 铁死亡信号通路在肝病中的调控机制示意图[2]
三、铁死亡研究策略与技术
1、基因筛选与分子鉴定
CRISPR-Cas9全基因组筛选是发现铁死亡新型调控因子的有力工具。例如,研究人员通过代谢酶文库筛选,发现了NANS是铁死亡的正调控因子。RNA干扰技术可用于靶向验证特定基因功能。一项研究通过合成靶向HDACs家族(HDAC1-11)的siRNA文库筛选,发现沉默HDAC1可显著促进Erastin诱导的铁死亡。分子生物学技术如染色质免疫共沉淀(ChIP)可用于研究转录因子与靶基因启动子的结合情况。研究表明,NF-κB亚基RelA可直接结合FTH1启动子,而NANS缺失增强这种结合。
2、细胞死亡确认与表型分析
铁死亡特异性抑制剂是确认铁死亡的关键工具。Ferrostatin-1和Liproxstatin-1是常用的铁死亡抑制剂,若它们能逆转细胞死亡,则表明死亡方式可能是铁死亡。
脂质过氧化检测是铁死亡表征的核心指标。C11-BODIPY??1/??1探针可用于检测细胞内脂质过氧化水平。
细胞内铁离子检测可使用Phen Green SK、RPA、RhoNox-1等荧光探针。
电镜观察可揭示铁死亡独特的超微结构特征:线粒体收缩、膜密度增加、嵴减少或消失。
3、先进成像技术
最新研究表明,荧光寿命成像显微镜(FLIM) 结合极性敏感荧光探针(如SBD-CH)可实时监测铁死亡过程中内质网极性变化,为早期检测提供新方法。这种技术优势在于荧光寿命是荧光分子的固有特性,与探针浓度无关,能避免传统强度型探针的成像失真问题。
四、疾病关联与靶向治疗前景
1、癌症治疗中的双刃剑
铁死亡在癌症中扮演双重角色:一方面,诱导铁死亡可抑制肿瘤生长;另一方面,某些肿瘤细胞可通过上调抗氧化通路获得铁死亡抵抗。在结直肠癌中,NANS表达水平与患者预后显著相关。研究发现,在铁死亡压力下,CDK1介导的NANS S275位点磷酸化,触发UBE2N依赖的泛素化降解,导致NF-κB-FTH1轴激活和铁死亡抵抗。联合使用CDK1抑制剂(如RO-3306)与铁死亡诱导剂,在动物模型中显示出协同抗转移效果。
2、非酒精性脂肪性肝病(NAFLD/NASH)
铁死亡在NAFLD/NASH发生发展中起关键作用。生物信息学分析鉴定出ZFP36、ATF3、SOCS1、IL-6、PTGS2、JUN等9个NASH铁死亡关键基因。实验证实,游离脂肪酸(FFA)处理的HepG2细胞中,c-jun、ZFP36、ATF3、IL-6蛋白表达升高,脂质过氧化增强。抑制铁死亡几乎可完全抑制NASH发生。
3、神经退行性疾病
在帕金森病、阿尔茨海默病等神经退行性疾病中,铁蓄积和脂质过氧化参与神经元死亡过程。GPX4失活导致脂质过氧化物(如4-HNE)累积,触发神经元膜结构破坏。转录因子AP-2γ与SP1的协同激活可上调GPX4表达,这一通路为神经保护提供了新靶点。
五、挑战与未来方向
当前铁死亡研究面临多项挑战:铁死亡与其他细胞死亡方式的crosstalk复杂;组织特异性调控机制尚不明确;靶向药物的递送效率和特异性不足。未来研究重点应包括:开发时空特异性诱导剂;探索组织特异性调控网络;优化纳米递送系统提高靶向性;深入研究翻译后修饰(如磷酸化、泛素化、乙酰化)调控机制。随着对铁死亡机制理解的深入,以及研究技术的不断创新,靶向铁死亡的治疗策略有望在癌症、神经退行性疾病和代谢性疾病等领域取得突破性进展。
参考文献
[1] Signaling pathways and defense mechanisms of ferroptosis. DOI: 10.1111/febs.16059
[2] Ferroptosis and liver diseases. DOI:10.3724/zdxbyxb-2024-0566
铁死亡研究产品推荐:
|
货号 |
名称 |
规格 |
|
abs580233 |
活性氧ROS检测试剂盒(红色荧光) |
500T |
|
abs90072 |
普鲁士蓝染色试剂盒(三价铁,增强型) |
20mL×4 |
|
abs126100 |
Rabbit anti-4 Hydroxynonenal Polyclonal Antibody |
100uL |
|
abs154673 |
Mouse anti-GSTO1 Monoclonal Antibody(JMMR-2558) |
100uL |
|
abs810466 |
Cisplatin |
50mg |
|
abs810744 |
Erastin |
5mg |
|
abs47006920 |
Glutathione |
20mg |
|
abs810754 |
Liproxstatin-1 |
5mg |
|
abs42007826 |
菲啰嗪一钠盐(铁离子检测指示剂) |
1g |
好消息!Absin文献奖励重磅升级!

Absin产品线:
爆款产品:十大试剂盒(mIHC、IHC、凋亡、ELISA、ChIP、Co-IP、TR-FRET、生化检测、残留检测、多因子检测);细胞培养(类器官试剂盒+基质胶,胎牛血清+培养添加剂+细胞因子)、分化试剂盒;分子(mRNA合成服务+提取试剂盒);化合物大包装;辅助试剂、耗材/仪器、定制服务(抗体/多肽/蛋白/标记/检测)...
特色产品:鸡胚提取物CEE、B27、N2、霍乱毒素B亚单位CTB、牛脑垂体提取物BPE、百日咳毒素PTX、重组人胰岛素Insulin、人源低密度脂蛋白LDL...
|
爱必信(上海)生物科技有限公司 联系邮箱:lanwu@univ-bio.com 微信公众号:爱必信生物 |
.jpg)
|